無菌鼠發展史
無菌動物的觀念最早於1885年由Louis Pasteur提出,一直到1946年才由Reynier成功培育出第一批無菌鼠 (Yi & Li., 2012)。早期無菌鼠飼養在笨重昂貴的不鏽鋼隔離操作箱(stainless steel isolator),後來逐漸被較輕盈易觀察的透明塑膠材質所取代。飼養無菌鼠的每顆isolator都有獨立的氣流過濾系統,且有特殊的運輸裝置和滅菌程序。因此,雖然無菌鼠模型已經有一段時間的發展史,但由於其繁殖、飼育、操作與品管流程繁複且不易簡化,因此無菌鼠中心的設置與維持仍需要耗費相當大的人力與技術成本 (Lundberg et al., 2016)。
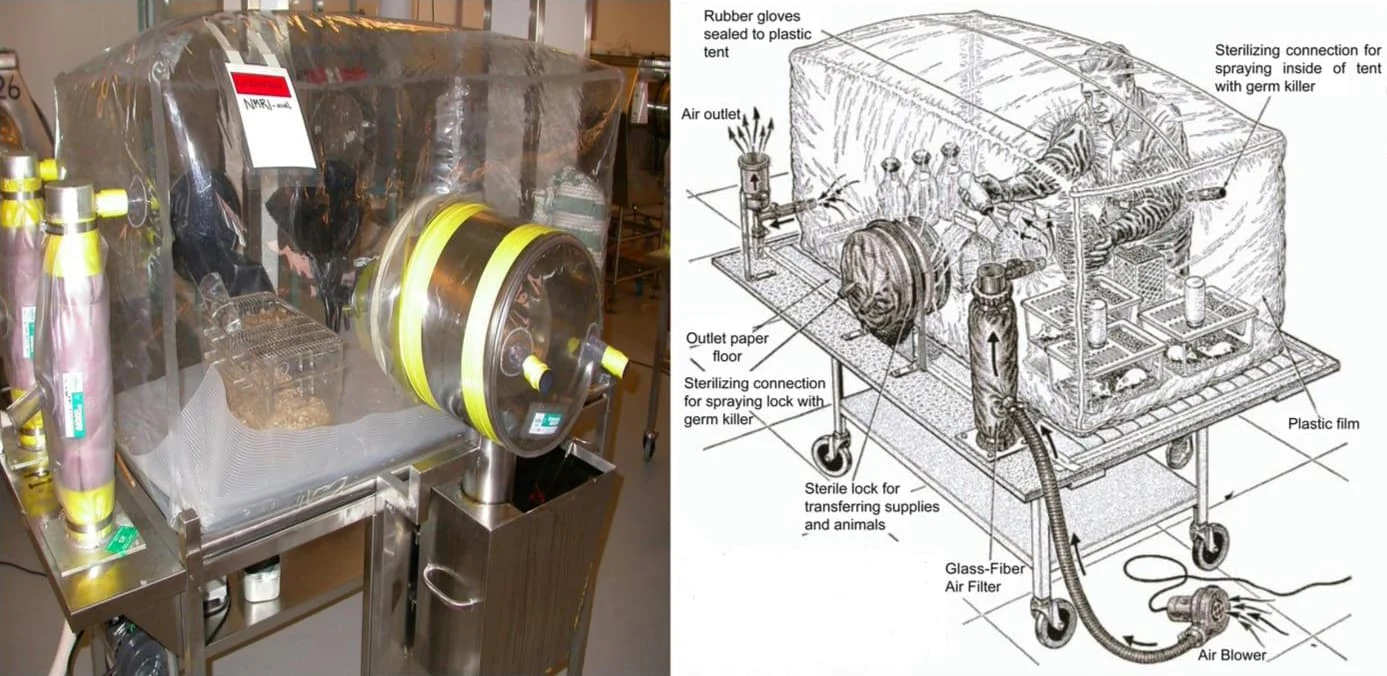
圖一、無菌隔離操作箱 (Al-Asmakh & Zadjali., 2015)
無菌動物模型在腸道菌研究之應用
- 單純菌群(Simplified Microbial Consortia)
過去由於基因定序成本高昂、腸道菌基因體資料庫不夠完整,無菌鼠實驗多半是將特定疾病模式動物無菌化(e.g. IL10-/- GFM for IBD model)之後,給予已知接種菌(defined bacteria inoculum)的方式,以單一菌株定植(mono-colonization)或是單純菌群組合( simple consortia colonization),進行腸道定植,來探討單一菌株或單純菌群與宿主間的交互作用與對疾病表徵的影響(Hormannsperger et al., 2015) 。這些給予無菌鼠已知菌群或菌種所產生的小鼠,稱為Gnotobiotic Mice (gnostos “known” and bios “life”,中文可翻作既知菌鼠、限菌鼠或悉生鼠,表示與此小鼠共生的菌株是已知的) (Rooks & Garrett., 2016)。較有名的例子為Altered Schaedler Flora (ASF) mice,其腸道菌相可以穩定地僅由8種已知菌株 (Clostridium species, Lactobacillus intestinalis, Lactobacillus murinus, Mucispirillum schaedleri, Eubacterium Plexicaudatum, Pseudoflavonifactor species, Clostridium species, Parabacteroides goldsteinii) 所構成,卻能讓小鼠擁有正常的腸道免疫、病原抵禦、與營養吸收能力,亦是探討腸道微生物與宿主交互作用常用的動物模型 (Aleksandar et al., 2013)。 - 複雜菌群(Complex Microbial Consortia)
約莫十年前開始,由於次世代基因定序(Next Generation Sequencing, NGS)技術的發展,降低研究複雜菌群中微生物宏基因體(Microbial metagenomics)的門檻,使研究人員可獲得比傳統DGGE (Denaturing Gradient Gel Electrophoresis)資訊更豐富的序列與物種結構,同時也讓無菌鼠模型的應用產生了一種蓬勃復興的狀態 (Turnbaugh et al., 2009; Lundberg et al., 2016)。特別在Jeffery Gordon實驗室於2006年發表ob/ob肥胖小鼠可以透過糞菌移植 (Fecal Microbiota Transplantation) 的方式,成功將肥胖表徵轉移給無菌小鼠之後,無菌鼠模型逐漸成為探討腸道菌群與疾病因果關係炙手可熱的研究工具 (Turnbaugh et al., 2006)。在接下來幾年,類似的實驗方法如雨後春筍般的湧現,包括糖尿病、心血管疾病、腦神經疾病、肝癌、關節炎、自體免疫疾病、過敏性疾病…等許多過去不認為與腸道菌有關的疾病表徵 (Disease phenotype) 或者疾病易感性(Disease susceptibility),均可以透過宿主腸道菌轉移給另一個宿主 (Hormannsperger et al., 2015),也開啟了腸道菌作為人類環境暴露因子導致慢性疾病成因的一個全新領域與方向。 - 仿人體腸道菌鼠(Humanized Gnotobiotic Mice)
然而,老鼠的腸道菌與人類腸道菌組成,因為宿主物種的差異性,只有15%的相似性 (Arrieta et al., 2016),因此動物實驗的結果只能視為腸道菌重要性初期的概念驗證 (proof of concept),仍須建立適合人類腸道菌研究的模型。Turnbaugh等人在2009年將健康成人糞便同樣以FMT成功移植85% (56/66) genus level taxa的捐贈者腸道菌至無菌鼠腸道中,建立第一個仿人體腸道菌鼠(Human Microbiota Associated Mice or Humanized Gnotobiotic Mice)模型,同時觀察人類腸道菌相在小鼠腸道中因為給予不同飲食而產生不同菌群結構的改變 (Turnbaugh et al., 2009)。此實驗模式的建立對於人類腸道菌與疾病和健康表徵的研究具有莫大的鼓舞,除了進一步確認人體腸道菌與疾病表徵和疾病易感性的因果關係外,也更能獲得接近人類腸道菌群調節宿主代謝與免疫的重要資訊,並且讓科學家能夠探討各種可能干擾腸道菌的環境因子,在活體內對於人類腸道菌組成與功能的影響。接下來的幾年,不少人類疾病與健康表徵成功的以人體糞菌移植在控制良好的無菌鼠模型上重現與探討,包括懷孕婦女妊娠期間產生的胰島素阻抗與體脂肪增加 (Koren et al., 2012)、雙胞胎成年後胖瘦表徵差異性 (Ridaura et al., 2013)、馬拉威孩童Kwashioker症的誘發因素 (Smith et al., 2013)、嬰幼兒腸道菌易感性與氣喘風險 (Arrieta et al., 2015)、發炎性腸炎菌群失調的功能性研究 (Nagao-Kitamoto et al., 2016)、微量營養素缺乏對人體腸道菌的影響(Nagao-Kitamoto et al., 2017) …..等。 - 人類糞菌巨量培養搜集模型 (Defined Complex Consortia)
雖然透過FMT產生的仿人體腸道菌鼠已經可以提供人類腸道菌群與宿主間免疫與代謝功能研究不少的資訊,但由於糞便組成實在過於複雜,菌群組成和代謝物成分變異性大,且有可能受到腸道內黴菌、病毒、噬菌體等非細菌界生物等干擾因子影響,因此要找出導致疾病表徵與易感性的關鍵菌群或菌株,仍有許多困難需要克服 (Ahern et al., 2014)。為了更精確的定義仿人體腸道菌鼠中的菌群,Goodman與Faith等人於2011年起,陸續發表了人類糞菌巨量培養搜集模型的方法 (Arrayed Bacteria Culture Collection; Goodman et al., 2011; Faith et al., 2014), 以定義型複雜菌群 (Defined Complex Consortia) 進行仿人體腸道菌鼠的介入性研究,使得研究影響宿主免疫與代謝表徵的菌群,能夠獲得較少誤差、更加明確的知識 (Charbonneau et al., 2016; Hibberd et al., 2017)。
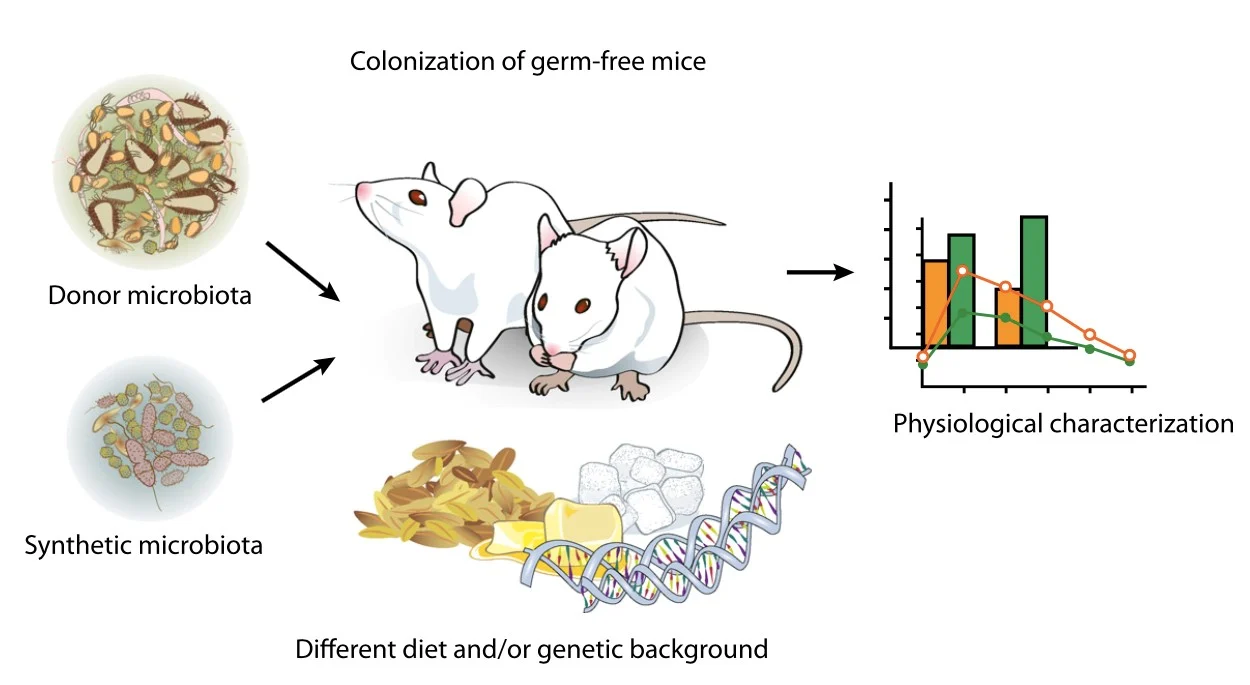
圖二、無菌鼠用於探討腸道菌對宿主影響的基本研究模式 (Karlsson et al., 2013)
無菌鼠的挑戰與限制
即使仿人體腸道菌動物模型近年來提供了許多令人振奮的發現,仍有不少挑戰與限制須面對。一般普遍認為,具有消化系統物種的共生腸道菌,是經過長時間與其宿主共同演化而來,因此腸道菌與宿主時常具有專一性 (Arrieta et al., 2016)。Chung等人便發現,人類菌群相較於小鼠菌群,刺激無菌小鼠腸道免疫成熟有較差的表現,且接受人類菌群的小鼠較易被病原菌所感染,顯示腸道菌與宿主的免疫成熟有其演化的專一性 (Chung et al., 2012)。其次,老鼠的基因、飲食、生活環境與習性都與人類迥異,其腸道微生態環境與人類有所不同,部分人類腸道菌並不能適應老鼠的腸道環境,因而無法成功定值,而人類腸道菌群且進入老鼠腸道中,也會因為生存環境的改變,各種微生物組成有消長的現象。Rawls等人曾利用無菌小鼠和無菌斑馬魚的模型,將小鼠與斑馬魚的糞便互相交換,發現成功定植於無菌小鼠和無菌斑馬魚的菌相,仍與原來物種菌相較相似,顯示菌群生態環境對菌相組成的重要性 (Rawls et al., 2006)。因此在進行仿人體腸道菌小鼠模型研究時,必須考量物種腸道環境選擇性對實驗結果所產生的影響 (Arrieta et al., 2016)。
展望
總結來說,無菌動物模型提供了腸道菌研究控制良好的腸道環境條件,對於腸道菌對於宿主的致病和保護機轉,能進行較明確且深入的探討,特別是仿人體腸道菌的應用,即使有其演化和生態學上的限制,仍可提供許多關於人類腸道菌有用的重要資訊。雖然因為生物技術的進步,部分腸道菌研究未來可望能使用Gut-on-a-Chip, HuMix○R, HMI,TM gut organoid等較簡單的體外腸道菌模型代替 (Sonnenburg et al., 2016; von Martels et al., 2017), 但由於無菌鼠模型有許多不可取代性,因此筆者認為這項歷史悠久的技術,仍會是未來10年腸道菌研究不可或缺的工具之一。
專家學者:吳偉愷 / 莊曉莉 / 吳明賢