抗生素如何使宿主肥胖
抗生素為目前已知對腸道菌影響最劇烈的物質,根據 Reijnders 等人的研究,給予肥胖受試者連續七日口服 1500mg vancomycin 和 amoxicillin,發現給予 vancomycin 的受試者腸道菌相明顯的改變,且糞便中短鏈脂肪酸 (short chain fatty acids, SCFAs) 與二級膽酸 (bile acids, BAs) 在給予 vancomycin 後也顯著下降 [1]。
而在另一篇研究中,Vrieze 等人給予代謝症候群患者連續七天口服 500 mg vancomycin 和 amoxicillin,給予 vancomycin 的受試者在試驗結束後腸道菌相明顯改變,並影響腸道中 bile acid hydroxylation 而使血清中一級膽酸濃度升高,進而透過影響肝臟 FXR 和 TGR5 而使受試者胰島素敏感性下降 [2]。
上述文獻指出,抗生素造成宿主肥胖可能源自於抗生素改變腸道菌的代謝物-短鏈脂肪酸與膽酸。SCFA可透過分佈於肝臟、脂肪組織、肌肉組織的接受器 GPR41/43 (G-protein receptor 41/43) 來調控該組織對於醣類與及脂肪的代謝 [3-7] 。而分佈於腸道的GPR41/43接受到 SCFA 的訊息後則可促進腸泌素 PYY(peptide YY)、GLP-1(glucagon-like peptide-1) 的分泌,而達到抑制食慾的效果 [8-9] 。 而膽酸具有數種接受器,除了肝臟中的膽酸的合成與排出主要依靠 FXR 調控 [10-11],FXR 亦可提升 peroxisome proliferator-activated receptor (PPAR)- alpha 的表現,促進肝臟中脂肪代謝 [12] 。Transmembrane G protein-coupled receptor (TGR5) 是另一個重要的膽酸接受器,TGR5 分佈於棕色脂肪組織、肌肉組織,可透過調節棕色脂肪及肌肉中的 type II iodothyronine deiodinase 提 升活化型甲狀腺素 Tri-idothyronine (T3) 濃度進而促進能量代謝 [13]。
畜牧業早已使用抗生素作為生長促進劑
早在 1950 年代,抗生素的生長促進作用就已經被發現並廣泛地應用在畜牧業上,抗生素生長促進劑 (antibiotics growth promoters, AGPs) 是政府核可於畜牧業中作為非治療用途的飼料添加劑,通常以亞治療劑量 (sub-therapeutic dose) 投與,作為提高飼料利用率、促進牲畜生長速率的用途 [14]。過去認為抗生素具有生長促進的作用,是建立在抗生素減少宿主腸道菌量,可以減少腸道微生物和宿主競爭養分,並預防牲畜因生病而造成生長狀況不佳的情形 [15]。由於 抗生素為畜牧業帶來的經濟效益十分可觀,根據美國農業部 2011 年的統計,美國自 2001 至 2011 年的十年間銷售給肉品製造業的抗生素是銷售給醫療院所治療病患的抗生素的三倍,且有逐年上升的趨勢。而國內動物用抗生素係根據動物用藥使用準則作為法令依據,其中第四條 -「含藥物飼料添加物使用規範」以正面表列方式允許 9 種抗菌劑 (Apramycin, Avilamycin, Bicozamycin, Enramycin, Flavomycin, Nosiheptide, Sulfamethazine, Tiamulin, Tylosin ) 與 17 抗球蟲劑 (Amprolium, Clopidol, Cyromazine, Decoquinate, Diclazuril, Ethopabate, Lisalocid, Maduramicin, Monensin, Narasin, Nicarbazin, Ormethoprim, Salinomycin, Semduramicin, Sulfadimethoxine, Sulfaquinoxaline, Zoalene) 在不需經獸醫師處方下由飼料商或畜牧業者使用,便是核准飼養業者將抗生素添加於牲畜飼料中作為生長促進劑 [16]。
亞治療劑量抗生素影響宿主代謝
近年來對於亞治療劑量抗生素的研究,提供了明確的科學證據來解釋抗生素促進動物生長的機制。根據 Cho 等人發表在 Nature 的研究,給予剛離乳的 C57BL/6J 小鼠亞治療劑量抗生素 (subtherapeutic antibiotic treatment, STAT: penicillin, vancomycin, penicillin+vancomycin, chlortetracycline) 介入七週,發現四組抗生素介入後皆使體脂肪增加,並且使血清 glucose dependent insulinotropic polypeptide (GIP) 上升,胰島素耐量測試 (oral glucose challenge test, OGTT) 則顯示 STAT 小鼠有高血糖的趨勢。根據小鼠糞便 SCFA 分析,STAT 組小鼠 SCFA 增加,而肝臟中脂肪代謝相關基因分析則發現三酸甘油脂 (triglyceride, TG) 合成相關基因表現提升,即可能是 SCFA 透過肝門靜脈運送至肝臟,調控肝臟基因表現以促進脂肪的合成,而使小鼠體脂肪增加 [17]。 另一篇 Cox 等人發表在 Cell 的研究則進一步探討生命早期介入亞治療劑量抗生素 (low-dose penicillin, LDP) 是否對於高脂飲食造成的肥胖具有加成的效果,結果則發現,比起只給予高脂飲食的小鼠,給予高脂飲食加 LDP 的小鼠體脂肪顯著上升,LDP 的介入更使高脂飲食造成的肝臟脂肪浸潤情形更為嚴重,並且大幅改變肝 臟代謝與免疫相關基因表現。另外,在迴腸基因分析結果則顯示 LDP 亦會降低腸道中抑菌胜肽 (antimicrobial peptides) 與 T 細胞的表現。為證實腸道菌是否為造成 LDP 小鼠代謝及免疫功能失調的主要因素,作者將 LDP 小鼠的及控制組小鼠的糞便以糞菌移植 (fecal microbiota transplantation, FMT) 方式給予無菌鼠 (germ free receptor),接受 LDP 小鼠糞便的 germ free receptor 糞便菌相組成在 FMT 後不但與 LDP 小鼠近趨相似,體脂肪也顯著上升,腸道免疫相關基因表現也有受到抑制的趨勢。此結果證實,亞治療劑量抗生素影響的腸道菌相即為調控宿主代 謝及免疫反應的獨立因子 [18]。
國際間對於食品添加物或殘留物的訂定
而國內外對於抗生素生長促進劑 在畜牧業使用上的控管,大多是在牲畜屠宰後至市場販售給消費者的供應鏈中,以制定最高容許殘留量 (maximal resudue limit, MRL) 的方式對肉品安全 進行把關。MRL 的計算方式是根據在實驗動物毒理實驗中所得到的未觀察到毒性之最高劑量 (no-observed adverse effect level, NOAEL) 除以一個安全係數 100 (10X10= 個體差異 X 物種差異 ) 後得到每日容許攝取量 (acceptable daily intake, ADI),再根據各國國民飲食調查的結果,估算飲食中每人每天可能從各種食物中吃到某物質的總量來計算某物質於食物中可接受的含量,作為不同食物中某物質殘留限量的標準。而理論上每人每日攝取最大量 (theoretical maximum daily intake, TMDI) 為代表某物質的膳食曝露量,計算方法為將某物質在每種食材的 MRL 各字乘上食材之平均攝食量後將之加總, 即為某物質之膳食曝露量。一般來說, TMDI 必須小於 ADI (TMDI 常以 % of ADI 表示 ),代表飲食中某物質的殘留不會對人造成危害,然而,根據國際農糧組織 / 世界衛生組織之食品添加物專家委員會 (Joint FAO/WHO Expert Committee on Food Additives, FAO/WHO JECFA) 的資料,某些動物用抗生素的 TMDI 為 ADI 的 80% 以上,甚至超過 100% ( 如 erythromycin 的 TMDI=130% of ADI) [19]。再者,即使單一種抗生素的飲食曝露量很低,但考量到食物中可能殘留的抗生素種類很多,每種抗生素對於腸道菌的影響是否又會有加乘的作用,或許需要額外設計實驗 來探討。
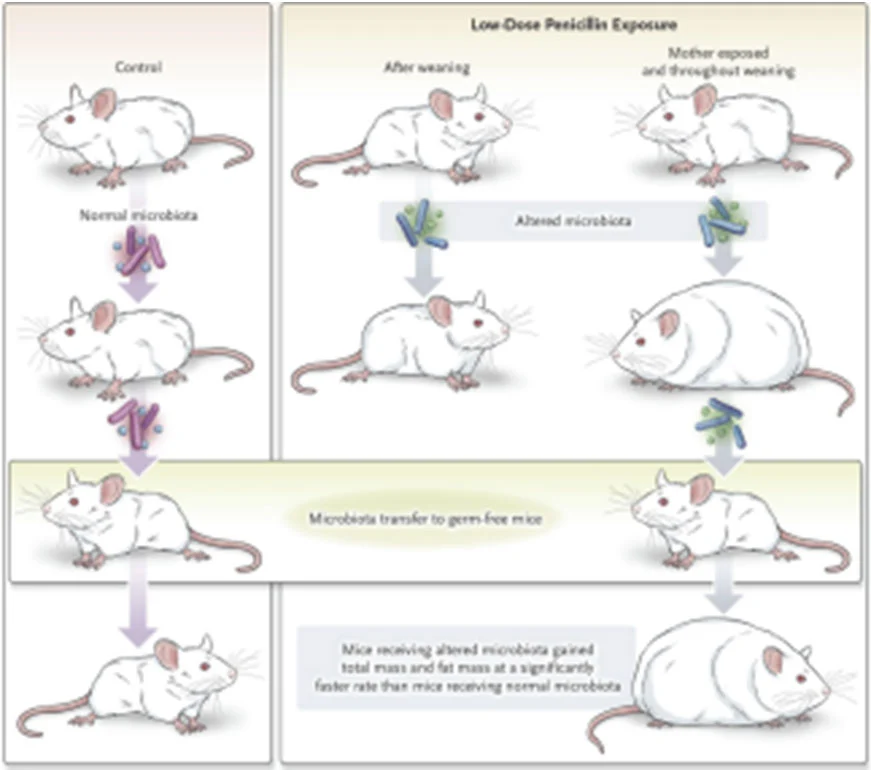
圖一 LDP 透過改變小鼠腸道菌相而使小鼠體脂肪增加,並在無菌鼠模型中得到驗證
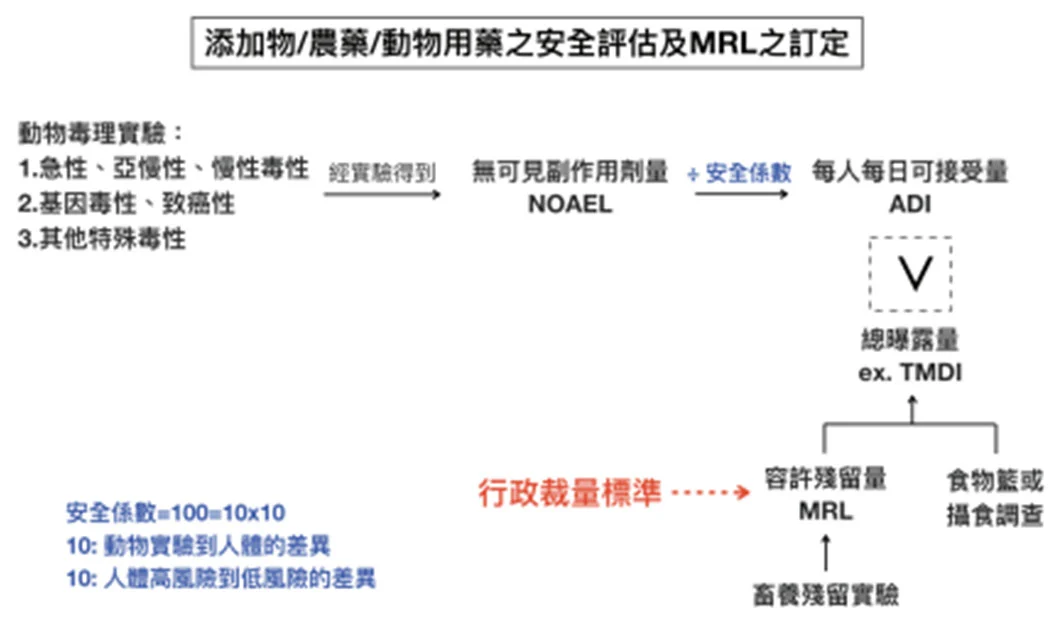
圖二 食品添加物、殘留物之安全評估與限量標準的訂定
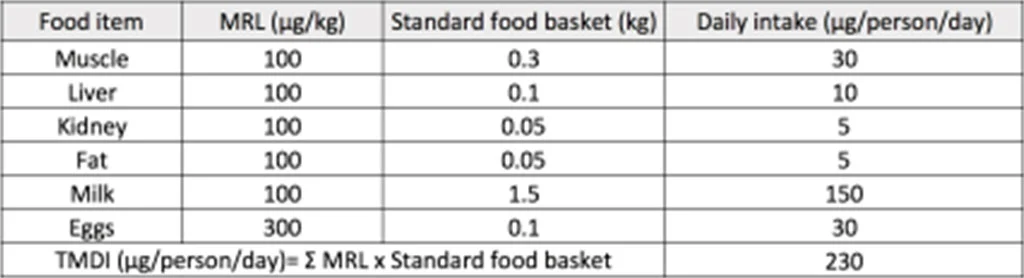
表一 範例:Tylosin 的 TMDI 計算
動物用抗生素的潛在食安問題
近年來國內食品安全的議題層出不窮,如何防範食安問題的出現已成為政府需要面對的一項重要課題。近年來不斷有研究探討食物中可能給宿主健康帶來影響的物質,也意味著食品安全的風險評估依據不是一成不變的。就如同動物用抗生素的議題,在人們長期食用肉品的情況下,食物中殘留抗生素限量標準的制訂與依據是否考慮充足,以及所謂「安全」的定義是否還需考量到與肥胖及代謝症候群等慢性疾病的發生,這些問題或許都需要依據流行病學的變遷來重新商榷。
專家學者:陳柔安 / 雷文虎克生物技術研究員
原文刊載於消化系醫學會第44屆教育研討會講義
參考文獻
- Reijnders D, Goossens GH, Hermes GD, et al. Effects of Gut Microbiota Manipulation by Antibiotics on Host Metabolism in Obese Humans: A Randomized Double-Blind Placebo Controlled Trial. Cell Metabolism (2016)
- Anne Vrieze, Carolien Out, Susana Fuentes, et al. Impact of oral vancomycin on gut microbiota, bile acid metabolism, and insulin sensitivity. Journal of Hepatology 2014
- Al-Lahham SH, Roelofsen H, Priebe M, et al. Regulation of adipokine production in human adipose tissue by propionic acid. Eur J Clin Invest 2010 May;40(5):401-7.
- Brown AJ, Goldsworthy SM, Barnes AA, et al. The Orphan G protein coupled receptors GPR41 and GPR43 are activated by propionate and other short chain carboxylic acids. J Biol Chem 2003 Mar 28;278(13):11312-9.
- Fushimi T, Tayama K, Fukaya M, et al. Acetic acid feeding enhances glycogen repletion in liver and skeletal muscle of rats. J Nutr 2001 Jul;131(7):1973-7.
- Bonini JA, Anderson SM, Steiner DF. Molecular cloning and tissue expression of a novel orphan G protein-coupled receptor from rat lung. Biochem. Biochem Biophys Res Commun. 1997 May 8;234(1):190-3.
- Canfora EE, Jocken JW, Blaak EE. Short-chain fatty acids in control of body weight and insulin sensitivity. Nat Rev. Endocrinol. 2015 Oct;11(10):577-91.
- Wichmann A, Allahyar A, Greiner TU, et al. Microbial modulation of energy availability in the colon regulates intestinal transit. Cell Host Microbe 2013 Nov 13;14(5):582-90.
- Lihong Jiang, Barbara Irene Gulanski, Henk M. De Feyter, et al. Increased brain uptake and oxidation of acetate in heavy drinkers. J Clin Invest 2013 Apr 1; 123(4): 1605–1614.
- Goodwin B, Jones SA, Price RR, et al. A regulatory cascade of the nuclear receptors FXR, SHP-1, and LRH-1 represses bile acid biosynthesis. Mol Cell 2000 Sep;6(3):517-26.
- Boyer JL, Trauner M, Mennone A, et al. Upregulation of a basolateral FXR dependent bile acid efflux transporter OSTα- OSTβ in cholestasis in humans and rodents. Am J Physiol Gastrointest Liver Physiol. 2006 Jun;290(6):G1124-30.
- Claudel T1, Staels B, Kuipers F. The Farnesoid X receptor: a molecular link between bile acid and lipid and glucose metabolism. Arterioscler Thromb Vasc Biol 2005 Oct;25(10):2020-30.
- Zietak M, Kozak LP. Bile acids induce uncoupling protein 1-dependent thermogenesis and stimulate energy expenditure at thermoneutrality in mice. Am J Physiol Endocrinol Metab 2016 Mar 1;310(5):E346-54.
- Dibner JJ, Richards JD. Richards. Antibiotic Growth Promoters in Agriculture: History and Mode of Action. Poult Sci 2005 Apr;84(4):634- 43.
- Brown K, Uwiera RRE, Kalmokoff ML, et al. Antimicrobial growth p r o m o t e r u s e i n l i v e s t o c k : a requirement to understand their modes of action to develop effective alternatives. Int J Antimicrob Agents 2017 Jan;49(1):12-24.
- 動物用藥使用準則 含藥物飼料添加 物使用規範
- Cho I, Yamanishi S, Cox L, et al. Antibiotics in early life alter the murine colonic microbiome and adiposity. Nature 2012 Aug 30;488(7413):621-6.
- Cox LM, Yamanishi S, Sohn J, et al. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences. Cell 2014 Aug 14;158(4):705-721.
- JECFA database (http://apps.who.int/ food-additives-contaminants-jecfa database /Search.aspx)
- Wang H, Wang N, Wang B, et al. Antibiotics detected in urines a n d a d i p o g e n e s i s i n s c h o o l children. Environ Int. 2016 Apr May;89-90:204-11.
- Wang H, Wang N, Wang B, et al. Antibiotics in Drinking Water in Shanghai and Their Contribution to Antibiotic Exposure of School Children. Environ Sci Technol. 2016 Mar 1;50(5):2692-9.
- Wang H, Ren L, Yu X, et al. Antibiotic residues in meat, milk and aquatic products in Shanghai and human exposure assessment. Food Control 2017 Oct P217-225


