科學家發現腸道菌相與人類疾病的相關性,除了有助於發展新的疾病診斷與預後工具,亦提供探討致病機轉一個新的思考與切入方向,包括透過改變微生物叢作為新的疾病治療手段。然而,腸道菌叢的變化會受到宿主本身的基因以及所處的環境、飲食、作息和疾病狀態所影響,腸道菌與疾病的關聯性包含許多複雜變因的集合,僅透過相關性研究並無法釐清腸道菌與疾病的因果關係。因此,腸道微生物叢與人類疾病的相關性研究,僅是腸道微生物叢研究的開端,仍需使用其他研究工具來建立腸道菌與疾病的因果性和相關機制,才有助於轉譯醫學後續的應用發展 (圖一)。
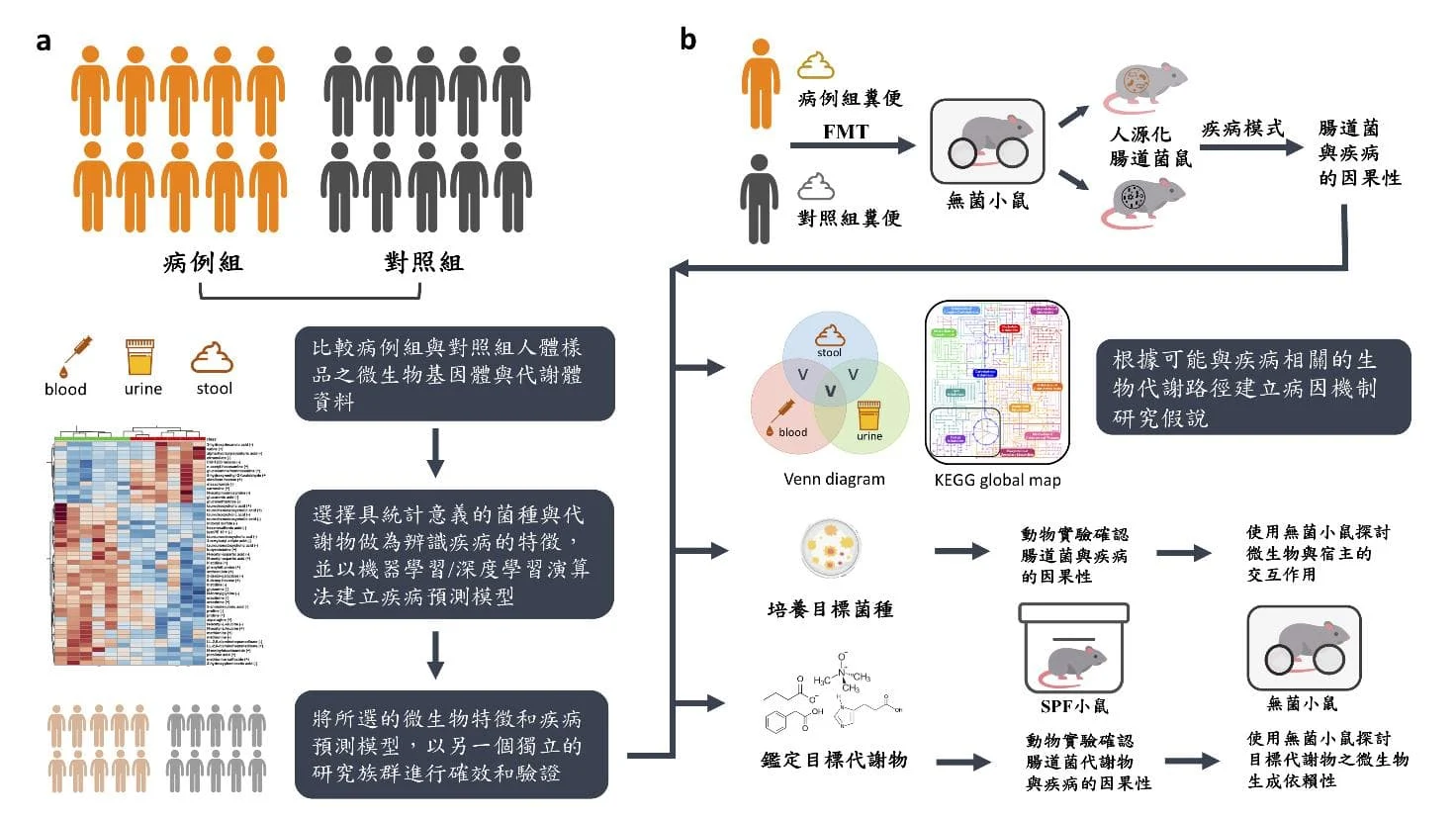
圖一 腸道微生物叢轉譯醫學研究方法與模式工具。
(a) 以病例—對照研究找出疾病相關腸道菌種與代謝物。
(b) 利用糞菌移植建立人源化腸道菌鼠,探討腸道菌與疾病的因果性。(modified from Wu WK et al. Rapid Commun Mass Spectrom 2020)
微生物總體基因體學 (microbial metagenomics)
隨著基因定序技術的進步,在人類後基因體時代,腸道微生物體學也跟著蓬勃發展,許多慢性疾病被發現與特定的腸道微生物叢組成或功能性基因具高度相關性,如心血管疾病、糖尿病、肥胖、脂肪肝、發炎性腸炎、類風濕性關節炎、阿茲海默症、帕金森氏症、自閉症等。目前常見的高通量定序設備包括短讀長的Illumina平台與長讀長的PacBio、Nanopore平台,且由於儀器與試劑的進步,定序成本大幅降低,不過大量序列資料仍需仰賴生物資訊專家對數據資料進行良好的品質管控、分類、優化與統計分析。
微生物代謝體學 (microbial metabolomics)
由於腸道菌種組成、微生物基因豐度與疾病的關聯性中,DNA無法代表具功能性的RNA與蛋白質表現與轉譯後修飾,距離利用微生物基因解釋人類疾病機轉仍有一段不小的距離,加上許多腸道厭氧菌不易培養,基因資料庫較不完整,不少基因產物的功能尚未被驗證,使得基因和疾病關聯性容易出現解釋意義偏差,因此直接針對腸道菌代謝物進行檢測分析,便成為一個直接探討腸道菌功能性的解決方案之一。近幾年科學家發現許多具生物活性且能調節宿主生理的腸道菌代謝物,包括TMAO, imidazole propionate, phenylacetate, indole propionate等,皆是使用高解析質譜進行代謝體分析並與疾病進行對照,找出與疾病相關之候選代謝物,再進行體外與動物實驗驗證。因此,針對具功能性小分子,代謝體分析提供探勘腸道菌活性分子較為直接的研究平台,有助於加速腸道菌小分子新藥的開發。
無菌鼠與微菌定植鼠模型 (germ-free mice and gnotobiotic mice model)
找出腸道微菌與疾病的相關性後,若要進一步探討腸道菌對疾病發生或治療預後的影響,需使用合適的動物實驗模式來進行因果性的驗證。其中,無菌鼠 (germ-free mice) 與微菌定植鼠 (gnotobiotic mice) 模型,便是驗證微菌與疾病因果性的黃金標準。然而無菌鼠設施的設置與維護需要耗費相當的人力與技術成本,不僅飼養無菌鼠的每顆隔離操作箱 (isolator) 都要有獨立的氣流過濾系統,且有特殊的運輸裝置和滅菌程序,其繁殖、飼育、操作與品管流程繁複且亦不易簡化。雖然這樣的技術維護不易,且操作門檻高,但其不僅可比較在有菌與無菌的狀態下,宿主的表型或基因表達是否受到腸道菌影響,亦可將特定菌株 (mono-colonization) 或特定菌群 (consortia colonization) 定殖於無菌鼠來研究微菌與宿主的交互作用、因果關係和分子機制,對於揭開腸道菌如何調控宿主免疫、代謝與神經功能的機制,或是菌相失調致使人類疾病發生的脈絡,都能獲得更深入的探討。在轉譯醫學應用方面,亦可將不同疾病表型的人類糞便移植至無菌鼠腸道中,建立人源化腸道菌鼠 (humanized gnotobiotic mice or human microbiota associated mice) 模型,來驗證臨床微菌基因體定序分析觀察到的結果,是否存在微菌與疾病表型的因果性。
厭氧菌培養體學 (anaerobic culturomics)
人類腸道微菌研究發展至今,已無法滿足於菌相與疾病相關性的發現,即使透過菌相基因體定序分析找到可能導致或保護疾病的特定菌種,仍需將目標菌種進行體外與動物實驗以驗證研究假說,唯有將目標菌株分離培養出來,才可針對特定菌種進行更明確的致病機制探討。由於人類腸道是無氧環境,絕大多數腸道中的細菌屬於厭氧菌,甚至是對氧氣極為敏感的絕對厭氧菌,一旦接觸到外在空氣很快就失去活性,無法進行活化培養。此外,由於人類腸道微菌種類與數量繁多,每公克的糞便中,細菌數量高達1011~1012,種類高達上千種,部分相對豐度比例較低的菌種 (relative abundance ≈ 0.01%),即使能進行體外培養,也很難在培養基上從成千上萬個菌株中挑選分離出來。因此,厭氧菌培養一直是過去研究腸道菌的難題。不過,近年來隨著厭氧培養與菌種鑑定方法的進步,加上人類微生物基因體資料庫的建立,許多過去認為無法培養的腸道菌逐漸被培養、分離與鑑定出來,特別是法國馬賽大學Didier Raoult所率領的微生物培養體團隊,利用多元的培養條件,搭配自建MALDI-TOF資料庫快速菌種鑑定方法,僅花費數年的時間,就將過去大多數已知的腸道微菌培養出來,並進一步分離培養出超過500株人體腸道新菌種。這項創舉為過去窒礙難行的腸道菌厭氧培養開啟一道曙光,預期未來將會有更多與人類疾病相關的重要微菌被發現、培養並闡明意義,為人類的精準醫療開創嶄新的契機。
結論
腸道微生物叢是近年興起的生物醫學領域,與人工智慧同樣被認為具有為現代醫療帶來巨大變革的潛力,目前相關研究正處於快速發展的萌芽階段,雖然在臨床應用尚未完全開花結果,卻已帶來許多嶄新的思維突破。未來腸道微菌的發展,將從關聯性的發現走向因果性的研究,最終回歸培養探討微菌與宿主的作用機制,為精準醫療的目標放上最後一塊拼圖。